Gentherapie bei SPG50 – Stand heute
Für SPG50 existiert heute erstmals eine Gentherapie – sie ist entwickelt, wird klinisch geprüft, aber noch nicht zugelassen.
Für seltene Erkrankungen, wie HSP50 gibt es in der Regel keine Therapien – nicht, weil sie medizinisch unmöglich wären, sondern weil sich ihre Entwicklung wirtschaftlich kaum trägt.
Im Fall von SPG50 ist dennoch etwas Außergewöhnliches gelungen.
Ausgehend von der Initiative eines betroffenen Vaters, Terry Pirovolakis, wurde in kurzer Zeit eine Gentherapie entwickelt. Sie verfolgt einen Genersatz-Ansatz: Eine funktionsfähige Kopie des betroffenen Gens wird in Nervenzellen eingebracht, um den krankheitsauslösenden Mangel auszugleichen. Ziel ist es, den Krankheitsverlauf zu stabilisieren oder deutlich zu verlangsamen – insbesondere, wenn die Therapie früh erfolgt.
Die Therapie existiert also bereits. Sie ist jedoch noch nicht zugelassen.
Was bisher passiert ist
Seit 2022 wurden erstmals Kinder mit SPG50 behandelt – mit ermutigenden Ergebnissen, aber noch ohne formale Zulassung.
Das erste Kind erhielt die Gentherapie im Rahmen eines individuellen Behandlungsansatzes. Die Behandlung wurde gut vertragen, und die ersten Beobachtungen waren ermutigend. Darauf aufbauend startete eine erste klinische Studie, in deren Rahmen weitere Kinder behandelt wurden.
Die bisher veröffentlichten Daten zeigen:
-
-
-
-
keine schweren therapiebedingten Nebenwirkungen
-
Hinweise auf eine Stabilisierung motorischer Funktionen
-
-
-
Diese Ergebnisse sind vielversprechend – aber sie ersetzen keine Zulassungsstudie.
Warum die Therapie trotzdem nicht verfügbar ist
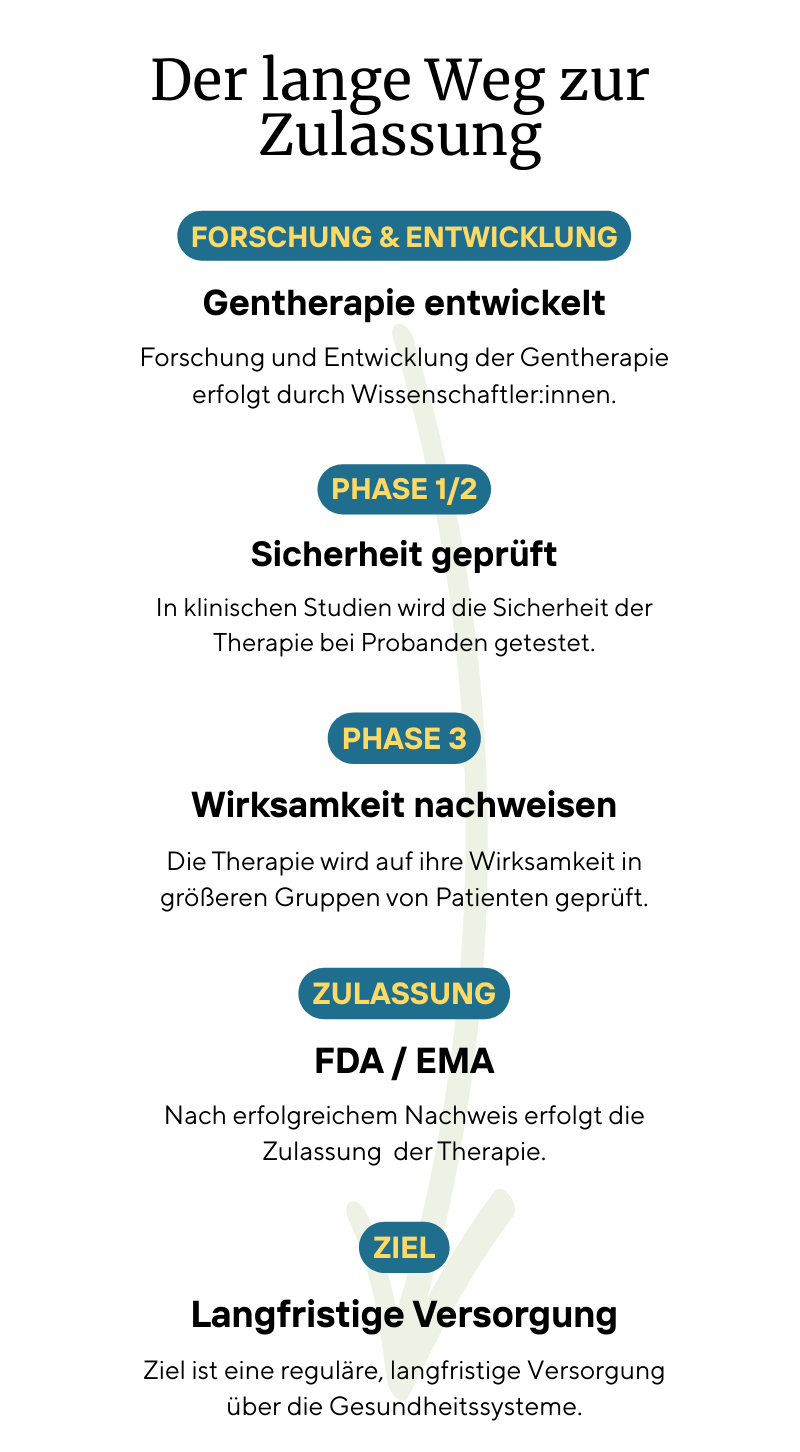
Die größte Hürde ist nicht die Wissenschaft, sondern der Weg durch Regulierung, Finanzierung und Studienstrukturen.
Für eine Zulassung durch Behörden wie FDA (USA) oder EMA (Europa) müssen Therapien mehrere klinische Phasen durchlaufen.
Die bisherigen Studien bei SPG50 entsprechen einer frühen klinischen Phase (Phase 1/2). In diesen Studien steht vor allem die Sicherheit der Therapie im Vordergrund: Wird sie gut vertragen? Treten schwere Nebenwirkungen auf?
Für eine offizielle Zulassung ist darüber hinaus eine Phase-3-Studie erforderlich. Diese dient dazu, die Wirksamkeit der Therapie systematisch nachzuweisen – also zu zeigen, dass sie den Krankheitsverlauf tatsächlich messbar beeinflusst. In den USA hat inzwischen diese entscheidende Phase-3-Studie begonnen.
Erst wenn sowohl Sicherheit als auch Wirksamkeit belegt sind, kann eine Therapie offiziell zugelassen und von Gesundheitssystemen finanziert werden.
All das ist teuer.
Und genau hier greift klassische Pharmafinanzierung bei seltenen Erkrankungen nicht.
Gleichzeitig haben sich die politischen und finanziellen Rahmenbedingungen für die Förderung klinischer Studien in den USA im letzte Jahr deutlich verschärft. Der Fokus der verfügbaren Mittel liegt dort zunehmend auf der Versorgung von Kindern innerhalb der USA.
Europa, Kinder – und die Realität
Auch in Europa wird an einem Zugang zur Gentherapie gearbeitet – doch er ist aktuell ausschließlich über wenige Studienplätze möglich.
Weltweit existieren derzeit allerdings nur 20 hergestellte Gentherapie-Dosen. Diese werden aktuell zwingend für die notwendigen klinischen Zulassungsstudien benötigt.
Das bedeutet: Auch in Europa ist der Zugang zur Therapie derzeit ausschließlich über Studien möglich – und die verfügbaren Studienplätze sind extrem begrenzt.
Aktuell besteht auch für Noemi die Chance, sich für einen Studienplatz in Europa zu bewerben.
Was jetzt zählt
SPG50 ist fortschreitend – Zeit ist einer der wenigen Faktoren, die wir beeinflussen können.
Die Fähigkeiten, die einmal verloren sind, kommen nicht zurück.
Deine Spende ermöglicht:
-
-
-
den Fortgang und Ausweitung klinischer Studien
-
die Bereitstellung weiterer Therapiedosen
-
die Behandlung von Kindern im europäischen Raum
-
und damit die Grundlage für eine spätere, reguläre Zulassung
-
-
Gemeinsam – nicht allein
Familien auf der ganzen Welt gehen diesen Weg gemeinsam – weil Zusammenarbeit bei seltenen Erkrankungen entscheidend ist.
SPG50 ist selten.
Aber wir sind nicht allein.
Danke, dass du diesen Weg mitgehst.

Stand: Dezember 2025